|
ЖЕЛЕЗО И СТАЛЬ. |
|||
|
Без преувеличения можно утверждать, что научно-технический прогресс был бы невозможен без железа и стали . С этими металлами мы встречаемся всюду. Стальные мосты переброшены через реки, тысячи и тысячи километров железных дорог соединяют между собой города и страны, по стальным трубопроводам текут нефть и газ, стальные балки служат несущим каркасом для заводских цехов и крытых стадионов, высотных зданий и телевизионных вышек, преимущественно из стали сделаны корабли, машины, вагоны и инструменты.
Одно только перечисление всех изделий и сооружений, изготовляемых из стали и железа, заняло бы целые тома. Потребность человечества в железе и стали растет очень быстро. Если в 1800 г. мировое производство стали лишь немного превышало 100000 т, то в 1900 г. оно составило около 7 млн.т. тo в 1960 г. достигло четверти миллиарда тонн. Спустя 30 лет мировая черная металлургия перешагнула через миллиардный рубеж.
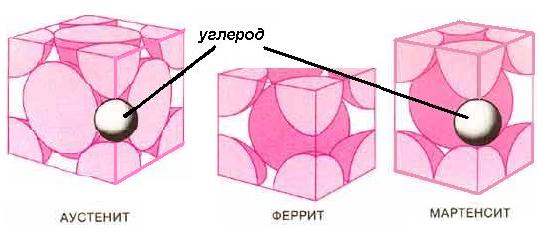
Чем же обусловлено господствующее положение железа в технике? Несомненно, важной предпосылкой явилось наличие большого числа пригодных для промышленной разработки месторождений железных руд. Но не только этим объясняется большое значение черных металлов. Еще более существенная причина заключается в том, что железо, как ни один другой металл, способно изменять свои технические характеристики в результате легирования и специальной обработки. В зависимости от рода и количества легирующих элементов металлурги получают металлические материалы с самыми различными свойствами. Сегодня в технике применяется более 15000 железных сплавов, главным образом сталей. Теоретически это число можно было бы значительно увеличить, однако не все возможные железные сплавы обладают такими свойствами, которые позволяют использовать их в качестве технических материалов. Для практического применения железные сплавы отбирают в соответствии с техническими и экономическими требованиями, руководствуясь при этом следующим основным правилом: материал должен быть хорош настолько, насколько это необходимо для данного конкретного применения, а не насколько это вообще достижимо. В этом состоит общий принцип рационального производства и применения технических материалов. Свойства металлического материала, например его прочность, твердость или коррозионная стойкость, меняются в широких пределах в зависимости от легирования и способов обработки. Влияние термической обработки особенно наглядно проявляется в твердости стали. Лучшие инструментальные стали в незакаленном состоянии обычно слишком мягки и мало пригодны для работы. Режущий инструмент из такой стали быстро изнашивается да и режет плохо. Если же раскаленную сталь охладить в воде, то она закаливается, приобретает высокую твердость и из нее получается отличный режущий инструмент. При различных состояниях обработки — мягком и закаленном — сталь ведет себя как два совершенно разных материала. Итак, железо и промышленные материалы на его основе (т. е. чугуны и стали) способны к превращениям, в результате которых их свойства резко меняются. В чем же заключаются эти превращения и каковы их причины? Чистое железо-представляет собой серебристо-серый, блестящий похожий на платину металл плотностью 7,87 г/см. Оно плавится при 1541 "С и, следовательно, принадлежит к металлам с высокой температурой плавления. Кристаллы железа построены из элементарных ячеек с кубической объемно-центрированной решеткой. Если железо нагревать, то его структура существенно изменяется. При температуре 911°С меняется его пространственная решетка: атомы перестраиваются таким образом, что элементарные ячейки приобретают кубическую гранеиентрированную структуру. Но и это состояние не сохраняется до точки плавления: при 1401° С атомы снова перестраиваются в кубическую объемно-центрированную решетку. При медленном охлаждении железа от температуры плавления такая двукратная перестройка структуры протекает в обратном порядке. Из расплавленного железа растут кристаллы с кубической объемно-центрированной решеткой, сохраняющейся до 1398° С. Ниже этой температуры решетка превращается в кубическую гранецентрированную, которая остается стабильной до 898° С. При дальнейшем охлаждении вновь образуется кубическая объемно-центрированная решетка. Различные формы существования железа (так называемые аллотропические модификации) обозначают как a, g-и d-железо. Читатель может спросить, почему здесь пропущена буква b. Действительно, прежде ее употребляли для обозначения немагнитного (вернее, парамагнитного) a-железа, существующего в температурном интервале 769—911° С. В нормальных условиях железо ферро магнитно: каждый знает, что железный магнит притягивает мелкие предметы. Но если железо нагревать, то начиная с температуры 769° С оно теряет ферромагнитные свойства. Эта температура названа точкой Кюри в честь выдающегося французского физика Пьера Кюри (1859—1906). Однако потеря ферромагнитных свойств не связана с изменением кристаллической решетки, поэтому от использования буквы b- для обозначения железа отказались. Изменение пространственной решетки в зависимости от температуры можно наблюдать не только у железа, но и у иных металлов, например у титана. Однако ни у какого другого металла легирование и термическая обработка не вызывают таких значительных изменений структуры и свойств, как у железа. ЖЕЛЕЗО И УГЛЕРОД. Чистое железо мягко, прочность его невелика, но когда в нем присутствуют легирующие элементы, оно становится тверже и прочнее. Из железа получают сталь, добавляя к нему углерод. Этот неметалл буквально творит с железом чудеса. Самые большие мосты через реки, ущелья, проливы сооружены из обыкновенной конструкционной стали, которая своей прочностью обязана углероду, содержащемуся в ней в количестве всего 0,2% (по весу). С увеличением содержания углерода прочность стали возрастает, и она приобретает способность к закалке. Но чем прочнее и тверже сталь, тем меньше ее вязкость и пластичность. Инструментальные стали, от которых требуются прежде всего твердость и закаливаемость, содержат 0,4—1,5% углерода, а иногда и больше. У сталей, особенно стойких к износу, содержание углерода достигает верхнего предела — около 2%. Если в стали, кроме углерода, нет других легирующих элементов, то ее называют нелегированной или углеродистой. Правда, в такой стали тоже содержатся другие металлические и неметаллические элементы: марганец, кремний, фосфор, сера, хром, никель, медь, азот, кислород или водород, но они не введены в нее специально, а попали из исходных веществ (железной руды, лома, топлива) как неизбежные примеси либо в процессе выплавки. Тонкими аналитическими методами можно обнаружить в нелегированной стали многие элементы периодической системы, но решающую роль в превращении железа в сталь играет именно углерод. С чем сравнить столь сильное влияние углерода? Два промилле (т. е. 0,2%) алкоголя в крови человека настолько меняют его поведение и реакции по сравнению с трезвым состоянием, что он кажется совсем другим человеком. Аналогично, два промилле углерода в железе превращают последнее в конструкционную сталь, т. е. материал с существенно иными свойствами. Правда, на этом и кончается аналогия между содержанием алкоголя в крови человека и содержанием углерода в железе: причины, механизмы действия и результаты здесь совершенно различны. Углерод может проникать в железо двумя способами. Так, атомы углерода могут занимать в пространственной решетке свободное место между атомами (ионами) железа (по размеру атом углерода приблизительно в два раза меньше атома железа). Однако при комнатной температуре в пространственной решетке железа таким способом может поместиться всего лишь 0,0001% углерода. Остальным атомам углерода приходится находить другие пути для внедрения в железо, и они находят их, вступая с железом в химическую связь. При этом образуется карбид железа Fе3С, состоящий из трех атомов железа и одного атома углерода.
Поэтому структура углеродистой (т. е. нелегированной) стали представляет собой смесь зерен железа и карбида железа. От количества и формы карбидных зерен, а также от их распределения в структуре в решающей степени зависят прочность, твердость и вязкость стали. Металлографы называют зерна железа -ферритом, а зерна карбида железа — цементитом. Структура, образующаяся при некоторых особых взаимных расположениях и соотношениях феррита и цементита, получила название «перлит» (буквально— подобный жемчугу). Если сталь содержит много перлита, то приготовленные из нее металлографические шлифы при косом освещении обладают характерным перламутровым блеском. Сплав железо—углерод, содержащий 0,80% углерода, целиком состоит из перлита. Строение перлита можно представить таким образом: в мягкой основной массе феррита очень близко, параллельно друг другу «уложены» мельчайшие твердые пластинки цементита. Слоистое,строение зерна перлита можно наблюдать в его поперечном разрезе. Если сплав железо — углерод содержит меньше 0,8% углерода, то его структура складывается из зерен феррита и перлита, причем доля последних тем больше, чем ближе содержание углерода к 0,80%. Если же в сплаве содержится 0,80—2,06% углерода, то структура такого сплава состоит из перлита и цементита. Еще большее содержание углерода имеют чугуны; в них помимо перлита и цементита присутствует еще одна структурная составляющая — ледебурит (названа в честь профессора металловедения Фрейбергской академии Альфреда Ледебура (1837—1906)), представляющая собой эвтектику. В заэвтектических чугунах (т. е. содержащих свыше 4,3% углерода) кроме ледебурита присутствует также карбид железа, который образуется непосредственно из расплава, и поэтому его называют первичным цементитом в отличие от вторичного цементита, который при охлаждении выделяется из твердого раствора углерода в железе. Диаграмма состояния железо—углерод столь же необходима металловеду, как карта географу. Диаграмма дает специалисту много важной информации о поведении сплавов железо—углерод при нагреве и охлаждении. Она совершенно необходима для понимания процессов термической обработки. Сегодня металлурги имеют в своем распоряжении более сложные диаграммы, которые позволяют судить о превращениях в легированной стали и устанавливать наилучшие режимы термической обработки. Но начало всему было положено диаграммой состояния железо—углерод. Именно она служит основой и исходной точкой современного развития теории и технологии железных материалов. Начиная с конца прошлого века ученые и инженеры, теоретики и практики достигли больших успехов в разработке новых сталей и чугунов. Заслуги уже упоминавшегося Альфреда Ледебура и англичанина У. Робертса-Остена (в старой русской и немецкой транскрипции — Аустен) отмечены тем, что их именами названы структурные составляющие в сплавах железо—углерод. Это ледебурит (эвтектика железа с углеродом, выделяющаяся из жидкого сплава) и аустенит (твердый у-раствор углерода в железе с кубической гранецентрированной решеткой). Подобной чести вполне заслужили и многие другие исследователи, но на их долю не хватило структурных составляющих в сплаве. Заканчивая описание диаграммы железо—углерод, следует отметить, что ее часто изображают двумя типами линий, причем пунктирные линии отражают поведение так называемой стабильной системы железо—графит, а сплошные — поведение метастабильной системы железо—цементит. Для сталей и чугунов практическое значение имеет только вторая система. |
|||
| ГЛАВНАЯ |
Знания даны для всех ! С© А.Гальперин |
||